Классификация белков
ЛЕКЦИЯ 2 (другие лекции по Биохимии)
В зависимости от химического состава белки делятся на 3 группы:
1) простые (протеины);
2) пептиды;
3) сложные (протеиды).
1. Простые белки построены из аминокислот и при гидролизе распадаются только на аминокислоты.
Протамины и гистоны – содержат до 85% аргинина, поэтому имеют выраженные основные свойства.
Белок сальмин, полученный из молок семги; клупеин – из молок сельди, скорее относятся к пептидам, т.к. имеют Mr не более 5000 Да.
Протамины в основном являются белковой частью нуклеотидов (ДНК). Гистоны сосредоточены главным образом в ядре и представляют белковую часть РНК.
Проламины и глютелины – белки растительного происхождения: зеин получают из кукурузы, глютенин - из пшеницы. Содержат до 25% глу, 10-15% про.
Альбумины и глобулины – содержатся в сыворотке крови, молоке, яичном белке, мышцах и т.д. Это глобулярные белки, отличающиеся различной растворимостью (альбумины растворяются лучше), по Mr (альбумины имеют молекулярную массу, равную 69000 Да, глобулины - 150000Да).
2. Пептиды – это низкомолекулярные азотсодержащие соединения, состоящие из остатков аминокислот и имеющие молекулярную массу менее 5000 Да.
а) с гормональной активностью (АКТГ, окситоцин, вазопрессин и др.);
б) участвующие в процессах пищеварения (секретин, гастрин);
в) содержащиеся в α2-глобулярной фракции сыворотки крови (брадикинин, ангиотензин);
г) нейропептиды (рилизинг-факторы гормонов, например нейрофизины I и II гипоталамуса, способствуют выделению гормонов окситоцина и вазопрессина).
3. Сложные белки или протеиды – состоят из двух частей: белковой и небелковой. Небелковую часть называют простетической группой, а белковую часть, утратившую простетическую группу, называют апобелком.
Название сложных белков | Простетическая группа |
| 1. Хромопротеиды в т.ч. гемопротеиды, флавопротеиды | окрашенный небелковый компонент гемовое железо производное изоаллоксазина ФАД, ФНН |
| 2. Нуклеопротеиды | РНК, ДНК |
| 3. Липопротеиды | липиды |
| 4. Гликопротеиды | олигосахариды, простые сахара |
| 5. Протеогликаны | полисахариды |
| 6. Металлопротеиды | негемовое железо, другие атомы металлов |
Подробно рассмотрим группу гемопротеидов – это Hb и его производное миоглобин (белок мышечной ткани), хлорофиллсодержащие белки и ферменты (цитохромы b, С, С1, каталаза, пероксидаза). Все они в качестве простетических групп содержат Fe (или Mg)–порфирины, а отличаются белковой частью.
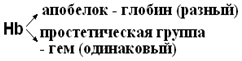
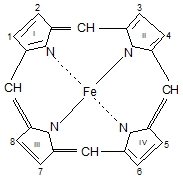
Структуру гема впервые раскрыл Ненцкий, а его синтез провел Фишер.
HbA1 – основной представитель Hb крови взрослого человека;
Фетальный HbF – в крови новорожденного содержится до 80%, к концу 1-го года жизни он почти полностью заменяется на HbA1.
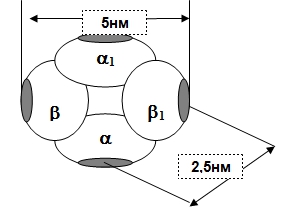
HbA состоит из 4 ППЦ: 2α–субъединиц и 2β–субъединиц. Четыре субъединицы или протомера ППЦ гемоглобина связаны друг с другом гидрофобными взаимодействиями. Молекула гемоглобина диссоциирует на два димера - αβ и α1β1. Каждый протомер содержит гем, находящийся в гидрофобной «нише», защищающей его от окисления в ферри-форму. Mr ППЦ гемоглобина равна 64458 (64500) Да.
В основе простетической группы Нb лежит протопорфирин, у которогоимеются: в положении 1,3,5,8-СН3– метильный R; в положении 2,4 СН1=СН– винильнный R; в положении 6,7 СООН–СН2–СН2 – остатки пропионовой кислоты. Железо, входящее в состав гемоглобина, имеет 2 ковалентные и 4 координационные связи; четыре связи образуют связи с атомами азота, пятая координационная связь присоединяет кислород к гему, шестая – связывает гем и ППЦ.
Структурная организация белков.
Одной из особенностей белков является их сложная структурная организация. Все белки обладают первичной, вторичной и третичной структурой, а те, которые в своем составе имеют две и больше ППЦ обладают и четвертичной структурой (ЧС).
Первичная структура белка (ПСБ) – это порядок чередования (последовательность) аминокислотных остатков в ППЦ.
Даже одинаковые по своей длине и аминокислотному составу белки могут быть разными веществами. Например, из двух аминокислот можно составить 2 разных дипептида:
При числе аминокислот, равном 20, число возможных комбинаций равно 2x1018. А если учесть, что в ППЦ каждая аминокислота может встретиться больше 1 раза, то число возможных вариантов трудно поддается подсчету.
Определение первичной структуры белка (ПСБ).
ПСБ белков можно определить с помощью фенилтиогидантоинового метода. Этот метод основан на реакции взаимодействия фенилизотиоцианата (ФИТЦ) с α-АК. В результате образуется комплекс этих двух соединений – ФИТЦ -АК. Например, рассмотрим пептид с целью определения его ПСБ, то есть последовательности соединения аминокислотных остатков.
ФИТЦ взаимодействует с концевой аминокислотой (а). Образуется комплекс ФТГ-а, его отделяют от смеси и определяют подлинность аминокислоты а. Например, это – асн и т.д. Последовательно отделяют и идентифицируют все остальные аминокислоты. Это трудоемкий процесс. Определение ПСБ белка среднего размера занимает несколько месяцев.
Приоритет в расшифровке ПСБ принадлежит Сенджеру (1953), который открыл ПСБ инсулина (Лауреат Нобелевской премии). Молекула инсулина состоит из 2х ППЦ – A и B.
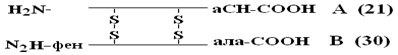
А-цепь состоит из 21 аминокислоты, цепь В – из 30. Между собой ППЦ соединяются дисульфидными мостиками. Число белков, ПСБ которых определена, к настоящему времени достигает 1500. Даже небольшие изменения первичной структуры могут существенно изменить свойства белка. В эритроцитах здоровых людей содержится HbA – при замене в β-цепи HbA, в 6-м положении глу на вал возникает тяжелейшее заболевание серповидно-клеточная анемия, при которой дети, родившиеся с этой аномалией, погибают в раннем возрасте. С другой стороны, возможны варианты изменения ПСБ, которые не сказываются на его физико-химических и биологических свойствах. Например, HbC содержит в 6-м положении b-цепи вместо глу – лиз, HbС почти не отличается по своим свойствам от HbA, а люди, имеющие в эритроцитах такой Hb, практически здоровы.
Стабильность ПСБ обеспечивается в основном прочными ковалентными пептидными связями и, во вторую очередь, дисульфидными связями.
Вторичная структура белка (ВСБ).
ППЦ белков обладают большой гибкостью и приобретают определенную пространственную структуру или конформацию. В белках различают 2 уровня такой конформации – это ВСБ и третичная структура (ТСБ).
ВСБ – это конфигурация ППЦ, то есть способ ее укладки или скручивания в какую-нибудь конформацию, в соответствии с программой, заложенной в ПСБ.
Известны три основных типа ВСБ:
1) α-спираль;
2) β-структура (складчатый слой или складчатый листок);
3) беспорядочный клубок.
α-спираль.
Ее модель предложена В. Полингом. Она наиболее вероятна для глобулярных белков. Для любой системы наиболее устойчивым является состояние, соответствующее минимуму свободной энергии. Для пептидов такое состояние имеет место, когда CO– и NH– группы соединяются между собой слабой водородной связью. В a-спирали NH– группы 1-го аминокислотного остатка взаимодействует с CO–группой 4-ой по счету аминокислотой. В результате пептидный остов образует спираль, на каждый виток которой приходится 3,6 АК-остатка.
Закручивание ППЦ происходит по часовой стрелке, то есть у спирали – правый ход. Через каждые 5 витков (18 АК; 2,7 нм) конфигурация ППЦ повторяется.
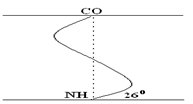
Стабилизируется ВСБ в первую очередь водородными связями, и во вторую – пептидными и дисульфидными. Водородные связи в 10-100 раз слабее обычных химических связей; однако за счет их большого количества они обеспечивают определенную жесткость и компактность ВСБ. Боковые R-цепи α-спирали обращены к наружи и расположены по разные стороны от ее оси.
β-структура.
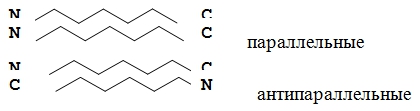
Это складчатые участки ППЦ, по форме напоминающие листок, сложенный в гармошку. Слои ППЦ могут быть параллельными, если обе цепи начинаются с N– или С–конца.
Если смежные цепи в слое ориентированы противоположными концами N–С и С–N, то они называются антипараллельными.
Образование водородных связей происходит, как и в α-спирали, между CO– и NH– группами.
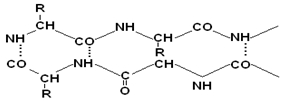
Содержание α-спирали и β-структуры в разных белках неодинаково. Не вся ППЦ уложена в спирали или складчатые слои.
Беспорядочный клубок
Некоторые участки вообще не имеют какой-либо правильной периодической пространственной конфигурации. Их обозначают как беспорядочный клубок, однако такие участки имеют свою фиксированную конформацию, которая определяется аминокислотным составом этого участка, а также ВСБ и ТСБ смежных областей, окружающих беспорядочный клубок. В областях беспорядочного клубка ППЦ могут легко изгибаться и изменять свою конфигурацию, в то время как α-спирали и β-структуры представляют собой довольно жесткие структуры.
Встречаемость α-спирали и β-структуры в различных белках.

Третьичная структура белка (ТСБ).
По форме своих молекул и особенностям пространственной структуры белки делятся на две группы – глобулярные и фибриллярные белки.
Форма глобулярных белков близка к сферической или эллипсоидной, короткая и длинная ось которых может относиться как 1:50. Фибриллы белков более удлиненной формы. Такой белок может образовывать многомолекулярные нитевидные агрегаты – фибриллы. Фибриллярные белки выполняяют в основном опорную функцию. Функции глобулярных белков более разнообразны. ТС глобулярных белков образуется путем дополнительного скручивания ППЦ, содержащей α-спираль, β-структуру и беспорядочные клубки. ТСБ образуется, главным образом за счет взаимодействия R, основную роль при этом играют дисульфидные связи, слабые водородные, ионные связи и особенно гидрофобные.
Дисульфидные связи приводят к тому, что удаленные друг от друга области ППЦ сближаются и образуют фиксированные петли.
Гидрофобные взаимодействия осуществляются за счет сближения R аминокислот с молекулой воды. Неполярные гидрофобные R, отталкиваясь от водного окружения, как бы втягиваются внутрь белковой молекулы, образуя там так называемые «сухие зоны». А гидрофильные R обращены к наружи образующейся глобулы и ориентированы в сторону воды. Все образующиеся химические связи определены аминокислотным составом и их чередованием в ППЦ.
Таким образом, ТСБ – это компактное расположение или упаковка в пространстве одной или нескольких ППЦ в определенном объеме.
Все биологические свойства белковой молекулы связаны с сохранностью их ТС, которая называется нативной конфигурацией белка.
Глобулярная молекула (глобула) не является абсолютно жесткой структурой. Небольшие изменения конфигурации белковых молекул происходят как внутри самой молекулы (как бы пульсация), так и при взаимодействии с другими молекулами и напоминает изменение формы резинового мяча при надавливании.
Денатурация и ренативация белка
При разрыве большого числа связей, стабилизирующих белковую молекулу, уникальная для каждого белка конформация нарушается. Такое изменение называется денатурацией. Ее можно вызвать при нагревании белка до 60-80oС и действии других агентов – детергентов, то есть щелочей, кислот, мочевины, спиртов и т.д. При денатурации растворимость белков ухудшается. Часто белок сворачивается. При денатурации утрачивается биологическая активность белков. В определенных условиях (медленное охлаждение денатурированного нагреванием белка, промывание раствора белка и вымывание из него детергентов) возможна ренативация (ренатурация), то есть восстановление исходной нативной конформации белка.
Четвертичная структура белка(ЧСБ).
Многие белки построены из 2 и более ППЦ, например гексокиназа содержит 2 ППЦ, HbA – 4 ППЦ, ферритин – 24.
Цепи соединяются между собой нековалентными связями. Например, основной белок эритроцитов Hb состоит из 4-х цепей: 2α и 2β. При сравнительно небольших изменениях окружающей среды Hb может диссоциировать на димеры, затем на мономеры (или протомеры).
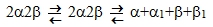
Димеры и протомеры называются субъединицами. Протомеры – это наименьшие субъединицы. Белки, молекулы которых построены из нескольких ППЦ, называются олигомерами или олигобелками.
Количество протомеров, способ их соединения и пространственной укладки относительно друг друга называются ЧСБ.
Белки с Mr больше 50 тыс. Да почти всегда являются олигомерными. ЧСБ является такой специфической уникальной характеристикой данного белка, как и другие уровни структурной организации. При соединении друг с другом протомеры взаимодействуют не любой поверхностью, а определенным участком – контактной поверхностью. Если на одной ППЦ (субъединице) имеется выступ, то на другой в соответственном месте имеется углубление. При этом совпадают разноименно заряженные ионные группы, группы, образованные водородной связью, гидрофобные и гидрофильные участки. Такие участки называются комплементарными. Они подходят друг к другу как ключ к замку. Процесс самосборки олигомерных белков отличается высокой специфичностью. Например, если в растворе наряду с протомерами Hb есть и другие белки, они не образуют соединений с Hb. Чаще всего отдельные субъединицы не обладают биологической активностью, белки приобретают эту способность при соединении протомеров в олигомер.
Гемоглобинозы
Биологическая активность белков находится в прямой зависимости от сохранности ПСБ. При замене хотя бы одной аминокислоты могут возникнуть различные патологии. Например, при даже незначительных изменениях в ППЦ Hb возникают аномальные гемоглобинозы. Их около 200. Гемоглобинозы делятся на две основные группы:
1) гемоглобинопатии;
2) талассемии.
Гемоглобинопатии – в их основе наследственное изменение структуры какой-либо цепи Hb. Например, серповидно-клеточная анемия (в основном в странах Южной Америки, Африки, Юго-Восточной Азии). Эритроциты в условиях низкого парциального давления принимают форму серпа. HbS после отдачи О2 (Полинг и авт.) превращается в плохо растворимую и выпадает в осадок в виде веретенообразных кристаллов, которые деформируют клетку и приводят к массивному гемолизу. Болезнь протекает остро и дети погибают в раннем возрасте. Причиной данной патологии является мутация в молекуле ДНК, кодирующей синтез β-цепи Hb, где происходит замена только 1-ой аминокислоты – глу на вал в 6-м положении. Ежегодно погибает около 1 млн. человек.
Талассемии – в основе – генетическое нарушение синтеза какой либо ППЦ Hb. При нарушении синтеза β-цепи возникают β-талассемии. Наряду с HbА1 обр. до 15% HbА2 и до 60% HbF – происходит гиперплазия и разрушение костного мозга, поражение печени, селезенки, деформация черепа, тяжелая гемолитическая анемия. Эритроциты приобретают форму мишени.