ПРЕДМЕТ И ЗАДАЧИ БИОХИМИИ.
ИСТОРИЯ БИОХИМИИ
ИСТОРИЯ БИОХИМИИ
ЛЕКЦИЯ 1 (другие лекции по Биохимии)
Биохимия – это наука о химическом составе живой материи, химических процессах, происходящих в живых организмах, а также связи этих превращений с деятельностью органов и тканей.
Таким образом, биохимия состоит как бы из трех частей:
1) статическая биохимия (это анализ химического состава живых организмов);
2) динамическая биохимия (изучает совокупность превращения веществ и энергии в организме);
3) функциональная биохимия (исследует процессы, лежащие в основе различных проявлений жизнедеятельности).
Все указанные разделы неразрывно связаны друг с другом и являются частями одной и той же науки – современной биохимии.
Возникнув на стыке смежных дисциплин, таких как органическая и физическая химия, биохимия в то же время не стала каким-то механическим объединением этих дисциплин, несмотря на их некоторую общность. Перед биохимией и смежными с ней науками стоят совершенно различные задачи.
Главным для биохимии является выяснение функционального, то есть биологического назначения всех химических веществ и физико-химических процессов в живом организме, а также механизм нарушения этих функций при разных заболеваниях.
Современная биохимия решает следующие задачи:
1. Биотехнологическую, т.е. создание фармацевтических препаратов (гормонов, ферментов), регуляторов роста растений, средств борьбы с вредителями, пищевых добавок.
2. Проводит разработку новых методов и средств диагностики и лечения наследственных заболеваний, канцерогенеза, природы онкогенов и онкобелков.
3. Проводит разработку методов генной и клеточной инженерии для получения принципиально новых пород животных и форм растений с более ценными признаками.
4. Изучает молекулярные основы памяти, психики, биоэнергетики, питания и целый ряд других задач.
КРАТКАЯ ИСТОРИЯ РАЗВИТИЯ БИОХИМИИ
Биохимия – это сравнительно молодая наука, она возникла на рубеже 19 в. Впервые в научной литературе термин «биохимия» использовал в 1903 году немецкий химик Карл Нойберг.
Как наука биохимия сформировалась относительно недавно, однако корни ее уходят в глубокую древность. Так на основе биохимических процессов развивались такие производства как сыроварение, хлебопечение, виноделие, выделка кожи и т.д.
Необходимость борьбы с болезнями заставляла задумываться о преврщении веществ в организме, искать объяснение целебным свойствам растений.
Авиценна (980-1037) – разработал первую химическую классификацию веществ, применяемых в медицине, и изложил ее в труде «Канон врачебной науки».
Средние века, период «алхимии» – это попытки создания химическим путем «панацеи» от всех болезней.
16-17 вв. – появилось особое направление «ятрохимия» от греч. «ятрос» – врач). Немецкий врач-ятрохимик Парацельс выдвинул прогрессивное по тем временам предположение о тесной связи химии и медицины.
Ван-Гель-Монт высказался о наличии в живых организмах факторов, участвующих в различных химических процессах.
17-18 вв. – немецкий химик и врач Шталь сформулировал теорию горючего начала – теорию «флогистона»: якобы в процессе горения из горючего вещества выделяется особое невесомое вещество – флогистон. Эти метафизические воззрения были опровергнуты работами Ломоносова и Лавуазье, которые открыли законы сохранения массы. Лавуазье показал, что при горении, также как и при дыхании поглощается О2 и выделяется СО2.
К концу 18 в. был накоплен большой практический материал и выделено огромное количество органических соединений растительного и животного происхождения. Работы Реомюра и Спалланцони положили начало изучению ферментов пищеварительных соков.
1814 г. – русский ученый Кирхгофф описал осахаривание крахмала под действием фермента амилазы. Либих (1839) выяснил, что главные компоненты животных и растений – это белки, жиры, углеводы.
Бертло (1854) – провел синтез жиров; Бутлеров (1861) – синтез углеводов.
Накопление большого числа сведений о химическом составе животных и растений, химических превращениях, которые в них происходят, привело к систематизации уже имеющихся данных в учебных руководствах Либиха – в Европе, Ходнева – в России. Повсеместно в медицинских институтах открывались соответствующие кафедры.
Таким образом, в конце 19 в., появилась новая отрасль химии – биологическая химия, т.е. химия жизни, химия жизненных процессов. При этом: были заложены главные направления биохимии; открыты основные классы соединений, содержащиеся в живых организмах; были выделены белки из многих животных и растительных организмов; изучение продуктов гидролиза белков привело к открытию аминокислот (АК).
Открытие швейцарским ученым Мишером в 1869 г. ДНК привело к изучению нуклеиновых кислот (НК). Были поставлены первые опыты по взаимопревращению жиров, белков, углеводов. Возникло учение о витаминах (Лунин, Эйкман, Функ и другие), о ферментах (Манасеина, Павлов), гормонах (Бернар).
В 20 в. биохимия достигла подлинного расцвета: Фишером была обоснована пептидная теория строения белков; Кноопом, Ленинджером – окисление и биосинтез жирных кислот; Кребсом, Мейергофом – созданы схемы биохимических превращений углеводов и образования АТФ. К середине 20-го столетия были заложены серьезные основы к развитию таких направлений как биоэнергетика, генная инженерия, молекулярная биология и др. Достижения биохимии широко применяются в медицине, фармации, народном хозяйстве.
Белки как уникальный класс биополимеров
Белки – это высокомолекулярные азотсодержащие органические соединения, построенные из остатков α-аминокислот (АК).
Белки также называют протеинами (греч. protos – первый, важнейший). Белкам принадлежит решающая роль во всех процессах жизнедеятельности, они не встречаются в неживой природе.
Живая природа обладает рядом свойств, отличающих ее от неживой природы: это
1) способность живых организмов к воспроизводству себе подобных;
2) сократимость, движение;
3) высокий уровень структурной организации;
4) способность к эффективному преобразованию и использованию энергии;
5) обмен с окружающей средой и саморегуляция химических превращений.
Все эти свойства живой природы в большей мере обусловлены наличием в ней белков. Таким образом, белки составляют основу и структуры, и функций живых организмов.
Физико-химические свойства белков
1. Высокая вязкость белковых растворов.
2. Водные растворы белков имеют ясно выраженный коллоидный характер. Стабилизация коллоидных растворов белков обеспечивается зарядом частиц коллоидного раствора.
3. Способность белковых растворов к набуханию в больших пределах.
4. Растворы белков оптически активны, подвижны в электрическом поле, поглощают УФ-лучи при 280 нм.
5. Благодаря наличию свободных СООН– и NH2– групп проявляют амфотерные свойства. Кроме того, белки имеют высокую Mr, обладают изоэлектрической и изоионной точкой, денатурируют и ренатурируют и т.д.
Элементный состав белков
В белках содержится до 55% – С; 20-25% – О; 16% – N, а также S, P, Mg и др. Доля азота в отличие от других элементов примерно одинакова и составляет 16% и содержание белка в материале часто определяют по количеству азота (сжигание по Къельдалю). Исключение составляет белки-протамины, которые содержат ~30% N.
Mr – относительная молекулярная масса белков. Она очень велика: от ≈6000Да до нескольких миллионов Да.
Например, Mr инсулина = 5733 Да, а вируса табачной мозаики – 40 млн.Да
Мономеры или структурные звенья белков.
Их можно определить путем кислотного гидролиза белков. Мономерами белков являются α-АК L-ряда. Соединение АК в полипептидную цепь (ППЦ) происходит посредством ковалентных пептидных связей –CO–NH–.
Сложная структурная организация.
Некоторые природные, а также искусственно полученные полипептиды могут иметь большую Mr, но отнести их к белкам нельзя. Отличает их от белков уникальный признак, присущий только белкам – денатурация. При действии определенных веществ, так называемых детергентов, происходит потеря белком физико-химических свойств, а главное – биологической активности, при этом пептидные связи не разрываются. Таким образом, белки обладают сложной пространственной организацией.
Таковы характерные признаки белков.
Форма белковых молекул.
В природе белки встречаются как в виде нитей – фибрилл, так и в виде шариков – глобул. Иногда глобулярные и фибриллярные формы встречаются в виде комплексов (в мышечной ткани комплекс актина с миозином; в плазме крови содержится фибрилл белка – фибриноген, а также глобулы белка – альбумины и глобулины).
Функции белков.
1. Каталитическая – более 99% ферментов или биологических катализаторов являются белками; например каталаза, аспартат-аминотрансфераза. К 90-м годам 20 в. идентифицировано более 2000 ферментов белковой природы.
2. Питательная (или резервная) – казеин – белок молока, овальбумины – белки яйца.
3. Транспортная – дыхательная функция крови, в частности, перенос О2 осуществляется гемоглобином (Нв) - белком эритроцитов.
4. Защитная – специфические защитные белки-антитела нейтрализуют действие чужеродных белков-антигенов.
5. Сократительная – специфические белки мышечной ткани актин и миозин обеспечивают мышечные сокращения и расслабления, т.е. движение.
6. Структурная – такую функцию выполняют белки – коллаген соединительной ткани, кератин – в волосах, ногтях, коже.
7. Гормональная – регуляция обмена веществ осуществляется за счет гормонов – белков или полипептидов гипофиза, поджелудочной железы.
Физико-химические свойства аминокислот
α-АК являются строительными блоками, из которых образуются белковые полипептидные цепи (ППЦ) и, собственно, сами белки. Аминокислоты – это производные карбоновых кислот, в которых один из водородов углеродной цепи замещен на R.
Путем гидролиза из животных белков выделяют 19-25 α-АК, но обычно их получают 20. Общая формула аминокислот:
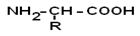
Аминокислоты – это бесцветные кристаллические вещества, плавящиеся при высоких температурах (>250 oС). Легко растворимы в воде и нерастворимы в органических растворителях. Имея в своем составе NH2–группу основного характера и COOH– с кислыми свойствами, АК обладают амфотерностью. В водных растворах α-АК в основном существуют в виде биполярных ионов или цвиттер-ионов с диссоциированной COO––группой и протонированной NH3+ –группой.
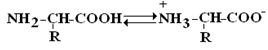
цвиттер-ион
В зависимости от рН–среды АК могут быть в виде анионов, катионов, нейтральных биполярных ионов или в виде смеси их форм.
В сильнокислой среде АК присутствуют в виде катионов (q +)
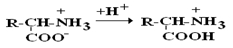
в сильнощелочной среде – в виде анионов (–q)
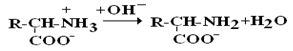
Величина рН, при которой в водном растворе преобладает цвиттер-ион, т.е. равновесная концентрация «+» и «–» q аминокислот, а также белков, называется изоэлектрической точкой (pI). При достижении такой рН белок становится неподвижным в электрическом поле и выпадает в осадок, что используется в электрофоретических методах анализа белков и аминокислот.
Стереохимия аминокислот.
Важным свойством АК является их оптическая активность в водных растворах. Это свойство АК обусловлено наличием в их структуре хирального атома С. Хиральным атомом или хиральным центром называется атом, у которого все связи замещены различными радикалами (R):
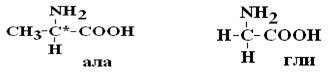
Оптически неактивной является только АК глицин, которая не имеет хирального центра.
Существуют два вида изомеров – структурные и стереоизомеры.
Структурные изомеры – это вещества с одинаковой Mr, но различной последовательностью связывания атомов в молекуле.

Стереоизомеры – это изомеры с одинаковой последовательностью соединения атомов, но с различным их расположением в пространстве.

Если 2 стереоизомера относятся друг к другу как предмет и его зеркальное отражение, их называют энантиомерами.
Энантиомеры всегда проявляют одинаковые химические и физические свойства за исключением одного – направления вращения плоскости поляризованного луча. Энантиомер, вращающий плоскость поляризации по часовой стрелке, называется правовращающим («+»), а против часовой стрелки – левовращающим («–»). Природные аминокислоты являются как «+», так и «–».
Смесь равного количества молекул правого и левого энантиомеров называется рацемической смесью.
Рацематы не обладают оптической активностью. По пространственному расположению атомов и радикалов вокруг хирального центра различают аминокислоты Д– и L–ряда. Для определения принадлежности АК к Д– или L–ряду сравнивают конфигурацию ее хирального центра с энантиомером глицеральдегида (ГА).
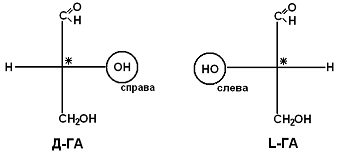
По аналогии, в аминокислотах если NH2–группа расположена справа от оси СООН-R, то это Д–АК, а если слева – L–АК.

Все аминокислоты природных белков являются α–АК.
Современная рациональная классификация аминокислот
в соответствии с ней все аминокислоты делятся на 4 группы.
I – Неполярные гидрофобные аминокислоты – их 8.
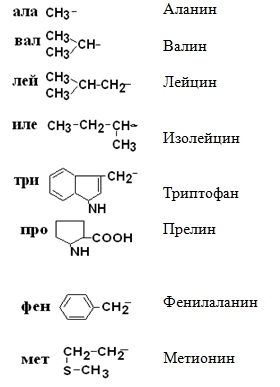
II –Полярные гидрофильные незаряженные аминокислоты – их 7.
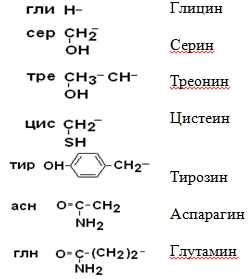
III – Отрицательно заряженные кислые аминокислоты
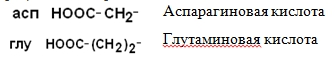
IV Положительно заряженные основные аминокислоты
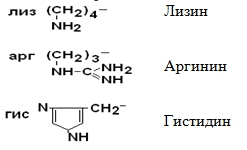

II –Полярные гидрофильные незаряженные аминокислоты – их 7.

III – Отрицательно заряженные кислые аминокислоты
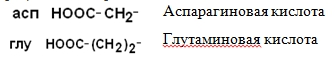
IV Положительно заряженные основные аминокислоты

Образование пептидных связей.
α–СООН группа одной аминокислоты может реагировать с α–NH2 группой другой аминокислоты с образованием пептидных связей.
Пептидные цепи белков – это линейные полимеры α–АК, соединенных пептидной связью.
Мономеры аминокислот, входящих в состав полипептидов, называются аминокислотными остатками, цепь повторяющихся групп –NH–CH–CO– называется пептидным остовом. Аминокислотный остаток, имеющий свободную NH2–группу называется N–концевым, а имеющий свободным α–карбоксигруппу – С–концевым.
Пептиды пишутся и читаются с N–конца.
Пептидная связь, образуемая аминогруппой пролина, отличается от других пептидных связей: у атома азота пептидной группы отсутствует водород, вместо него имеется связь с R.
Пептидные связи очень прочные, для их неферментного гидролиза in vitro требуются жесткие условия: высокие to и p, кислая среда, длительное время. In vivo, где нет таких условий, пептидные связи могут разрываться с помощью протеолитических ферментов (E), называемых протеазами или пептидгидролазами.
Полипептидная теория строения белков была предложена в 1902 г. Э.Фишером, в ходе дальнейшего развития биохимии эта теория была экспериментально доказана.
Экспериментальные доказательства полипептидного строения белков
1. Титруются только концевые COOH– и NH2– группы.
2. При гидролизе белков образуется стехеометрическое количество титруемых COOH– и NH2–групп (происходит распад определенного числа пептидных связей).
3. Под действием протеолитических ферментов (протеаз) белки расщепляются на строго определенные фрагменты с концевыми аминокислотами, соответствующими избирательному действию протеаз.
4. Биуретовую реакцию (раствор сульфата меди CuSO4 в щелочной среде – сине-фиолетовое окрашивание) дают и биурет (NH2–CO–NH–CO–NH2), содержащий пептидную связь и белки.
5. Проведенный рентгеноструктурный анализ (разрешительная способность 0,15-0,2 нм) показывает на рентгенограмме пептидную связь.
6. Самое убедительное доказательство – это синтез химическими методами белков с уже расшифрованной структурой. Синтезированные белки обладают физико-химическими свойствами и биологической активностью, аналогичными природным белкам .